申請の手続き・注意点
【研究倫理に関する規則】 本学の研究倫理審査の規則は原則として「人を対象とする生命科学・医学系研究に関する倫理指針」に基づいています。研究を立案・計画する際には指針及びガイダンスを確認してください。指針に記載のない本学の規則については本学の規程類を参照いただくか事務局にお問い合わせください。 【倫理審査のタイミング】 研究の種類(介入研究・観察研究)や発表形式(学会発表・論文発表)に関係なく、研究開始前(抄録作成前)に必ず審査・承認を受ける必要があります。倫理審査・研究機関の長の許可・研究対象者への情報公開を経ずに研究を開始した場合は重大な指針違反とみなされます(遡って審査を受けることはできません)。 【研究機関の長の実施許可】 研究倫理審査委員会の承認とは独立して、研究機関の長(医学部では医学部長、病院では病院長)の実施許可が必要です。他機関での中央一括審査で承認された研究でも本学での機関の長の許可を得るまでは研究は開始できません。 【研究期間の定義】 研究期間は通常、解析や論文発表を含むすべての研究活動が終了するまでの期間を指します。論文投稿前に追加解析が必要となる可能性がある場合は、研究を継続することが推奨されます。研究を再開するには新たな研究としての申請が必要です。 【研究期間の制限】 本学では1回に申請できる研究期間は5年以内と定められています。研究期間を延長する場合は、期間内に変更申請を行い、延長手続きをしてください。 【既存試料・既存情報】 診療の目的で取得され、研究に利用されるかどうかにかかわらず、すでに存在する試料や情報のことを指します。これらが過去に取得されたものか、今後取得されるものかは問いません。ただし、申請時より未来に取得される試料や情報を用いた研究を行う場合には、「前向き」用の申請書類を使用する必要があります。 【同意取得の形式】 研究の内容に応じて、個別文書同意、適切な同意(必要十分な簡略化された説明同意形式)、オプトアウトによる拒否機会の提供、研究内容の情報公示のみ、の4種類の形式が考えられますが、既存試料や既存情報のみを使用する研究においても、必ずしもオプトアウト方式で同意を取得することが適切であるとは限りません。まず研究者が同意取得方法を検討し、その妥当性を委員会が判断します。 【診療と研究の線引き】 通常の診療で行われる範囲と、研究で行われる内容を明確に区別し、申請書に記入する必要があります。通常診療として介入が行われる場合は観察研究、介入が研究として行われる場合や、観察研究の結果が診療に用いられる場合には介入研究となります。 【研究対象者の範囲】 研究に使用される試料や情報の提供者がすべて研究対象者となります。たとえば、患者以外に医療従事者の情報を使用する場合、患者と医療従事者の両方が研究対象者となる可能性があります。 【研究開始後の報告や申請】 研究開始後は、1年ごとの研究実施状況報告(定期報告)、有害事象や、指針や研究計画書からの逸脱などが発生した場合の報告、研究終了時の報告、研究内容や研究者に変更が生じる場合の変更申請が必要です。 【症例報告】 一般的な症例報告は倫理審査の対象とはなりませんが、少数の症例報告であっても研究的要素が含まれる場合、倫理審査が必要になることがあります。さらに、学会や投稿雑誌が倫理審査を要求する場合もあります。判断が難しい場合は、事務局に相談してください。 【学外から申請される方へ】 学外の方の倫理審査を受け付けておりますが、お引き受けできるかどうかは、具体的な研究内容に基づいての検討が必要です。詳細については事務局までお問合せください。 【規定・細則・実施要項】 臨床研究を実施する前に必ず下記の規則、細則を参照してください。 なお、研究実施(第4条)、安全性情報・有害事象(第11条)、インフォームドコンセントの取得(第15条)、試料・情報の保存 (第20条)、個人情報の管理(第28条)については、実施要項の関係の条項を確認してください。
東海大学医学部「人を対象とする生命科学・医学系研究」に関する審査規程
申請の流れ
- 申請
- 上記注意点を確認のうえ、申請書類を作成してください。 押印が必要な書類は原本をご提出ください。その他の書類はメール添付で結構です。 申請前に利益相反申告を別途行ってください。
- 審査
- 臨床研究審査委員会にて審査を行います。
- 審査結果
- 病院長決裁後「臨床研究の実施に関する通知書」が、申請者宛てに送付されます。(およそ委員会開催月の末日頃)
審査結果について
審査結果は主に3つに分かれます。それぞれの注意事項をご確認ください。
- 承認
- 【実施上の留意事項及び条件又は非承認の趣旨等】に指摘事項がない場合は、医学部長および付属病院長より実施許可が発行されます。研究は、実施許可が発行された日より実施できます。
- 継続審議
- 【実施上の留意事項及び条件又は非承認の趣旨等】の指摘事項の内容について修正し、必要書類を速やかに臨床研究推進室に提出してください。修正内容を事務局及び委員長が確認後に、委員会として「承認」されます。事後、医学部長及び付属病院長より「実施許可」が発行されます。研究は、この実施許可がないと実施できません。
- 不承認
- その研究の実施は認められません。
1 各種審査手続き
A 新規
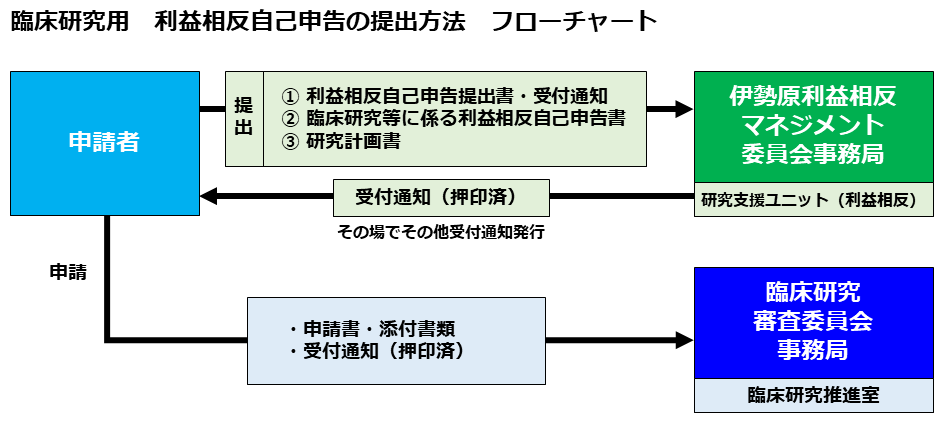
(1)利益相反必要書類・提出先(学内関係者のみ)
1)受付通知書
2)自己申告提出書
上記2種は伊勢原研究支援課ホームページからダウンロードお願いいたします。
3)COI自己申告書
申請書類一覧の研究計画書からダウンロードお願いいたします。
4)研究計画書
提出先
研究支援ユニット(利益相反) 伊勢原校舎 1号館 5階
(2)臨床研究審査委員会に該当する研究 必要書類・提出先
B 実施許可
新規・継続・変更の各申請に対する審査結果が「承認」であっても即座に研究を開始することはできません。医学部長・病院長への実施許可申請が必要です。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
付属病院(伊勢原):臨床研究推進室(伊勢原校舎2号館 2H01)
付属病院(伊勢原)以外:各付属病院における臨床研究事務担当
C 継続(定期報告)
臨床研究(未承認薬・機器・材料、院内製剤含む)の実施期間が1年を超える場合には、1年毎に臨床研究審査委員会にて継続についての承認が必要です。
「臨床研究等定期報告書」を1年に1回以上提出し、継続審査を受けてください。
委員会開催日程
委員会日程・申請締切からご確認をお願いいたします。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
D 変更
研究計画(未承認薬・機器・材料、院内製剤含む)の変更を行う場合は、臨床研究審査委員会の承認が必要です。なお、承認日より1年を経過した研究については「定期報告書」の提出がなければ、変更申請を受け付けることはできません。
「臨床研究等定期報告書」を1年に1回以上提出し、継続審査を受けてください。
委員会開催日程
委員会日程・申請締切からご確認をお願いいたします。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
E 重篤な有害事象報告
重篤な有害事象等とは、次に掲げるいずれかに該当するものです。
(1)死に至るもの
(2)生命を脅かすもの
(3)治療のため入院または入院期間の延長が必要となるもの
(4)永続的または顕著な障害・機能不全に陥るもの
(5)子孫に先天異常を来すもの
臨床研究審査委員会への報告が必要です。
必要書類を速やかに提出してください。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
F 不適合報告
重大な不適合があった場合は、臨床研究審査委員会への報告が必要です。
「重大な不適合報告書」を速やかに提出してください。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
G 終了
臨床研究(未承認薬・機器・材料、院内製剤含む)を終了した場合は、臨床研究審査委員会へ報告が必要です。
「臨床研究等終了報告書」を1ヵ月以内に提出してください。
委員会開催日程
委員会日程・申請締切からご確認をお願いいたします。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
H 中断・中止
臨床研究(未承認薬・機器・材料、院内製剤含む)を中断・中止した場合は、臨床研究審査委員会へ報告が必要です。
「臨床研究等中断・中止報告書」を1ヵ月以内に提出してください。
委員会開催日程
委員会日程・申請締切からご確認をお願いいたします。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
I 取り下げ
審査前(申請書類受付後)および承認前に研究課題の申請を取り下げる場合は、書類の提出が必要です。
「臨床研究等申請取り下げ願い」を速やかに提出してください。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
2 付属病院(伊勢原)の臨床看護研究について
東海大学医学部付属病院(伊勢原)の看護部の方が行う臨床看護研究の研究審査については、臨床看護研究審査委員会にて必ず審査を受けてください。臨床看護研究審査委員会で承認された研究課題のみ、臨床研究審査委員会へ申請が可能です。
東海大学医学部付属病院(伊勢原)以外の看護部が行う臨床研究の研究審査については、臨床研究推進室(伊勢原校舎2号館 2H01)に申請書類を提出してください。
臨床看護研究審査委員会のお問い合わせ先
臨床看護研究審査委員会 和田 峰香
付属病院(伊勢原) 看護部 【内線:5722】
3 その他
既存試料・情報の他機関への提供
既存の試料・情報を他機関に提供する場合は、次の書類を提出してください。
必要書類
・主たる研究機関での倫理審査承認書写し
・研究計画書
・東海大用情報公開文書
・様式SI様式1 他の研究機関への試料・情報の提供に関する申請書
・様式(3) 他の研究機関への試料・情報の提供に関する記録
申請書類一覧からダウンロードお願いいたします。
申請書類提出先
臨床研究推進室(伊勢原校舎2号館 2H01)
臨床研究検査依頼
臨床研究を実施するにあたり臨床検査技術科に依頼する検査等がある場合は、倫理審査(実施許可)申請前に必ず臨床検査技術科と打合せを行い、検査依頼書の提出が必要です。
必要書類
申請書類一覧からダウンロードお願いいたします。
申請書類提出先・お問い合わせ先
診療技術部 臨床検査技術科
検体検査 内線:6095(5号館地下)
生理検査 内線:6247(5号館2階)
院内製剤使用許可
2017年4月1日より、院内製剤の使用許可については、担当部署が変更になりました。
詳しくは下記連絡先にお問い合わせください。
お問い合わせ先
医療監査部 医薬品安全管理室(1号館2階) 内線:3165
院外からのモニタリング・監査
本申請書は東海大学医学部付属病院(伊勢原)の研究のうち、
院外の方が実施者として行われるモニタリング・監査を対象としています。
必要書類
申請書類一覧からダウンロードお願いいたします。
人数分必要な書類もありますのでご注意ください。